Ситуация с раком легких, по данным Всемирной организации здравоохранения, является одной из самых сложных среди онкологических заболеваний. Количество пораженных данной патологией людей год от года возрастает.
Рак легких отличается агрессивным течением: опухоль обладает способностью увеличиваться вдвое всего за месяц. Коварство рака легкого в том, что на ранней стадии болезни симптомы практически отсутствуют, и в большинстве случаев больные обращаются к врачу только тогда, когда возможность успешного излечения практически упущена.
Возможности классических методов лечения рака легкого на запущенных стадиях довольно ограничены. К тому же еще совсем недавно протоколы консервативного лечения у больных с разными видами этой патологии были идентичны, без учета гистологии и цитологии новообразования.
Одной из из самых перспективных инновационных технологий в лечении рака легких является медикаментозное лечение биологическими препаратами – биологическая (таргетная) терапия. Такое лечение является консервативным, и при этом оно имеет гораздо меньше побочных эффектов, чем химиотерапия. Благодаря применению метода таргетной терапии продолжительность жизни пациентов с запущенной формой рака легких удается существенно увеличить, что является крупным достижением в онкологии.
Результатом применения данных препаратов становится торможение роста опухолевого образования в легких и процесса метастазирования, а также постепенная гибель уже существующих злокачественных клеток.
Механизм таргетной терапии рака легких
Поскольку принцип действия таргетной терапии затрагивает молекулярные механизмы ракового заболевания, этот вид лечения носит еще и другое название – молекулярная таргетная терапия.
В 90-е гг. XX века учеными-онкогенетиками были открыты большинство механизмов, регулирующих рост, выживаемость и прогрессирование раковых опухолей. Было установлено также, что блокировка одного или другого из этих механизмов с помощью определенных препаратов позволяет остановить развитие процесса и добиться его регрессии.
— Специфические иммуноглобулины – молекулы, по строению схожие с теми, которые синтезируются в организме как иммунная реакция на внедрение инфекционного агента;
— Блокаторы ферментов – препараты, тормозящие функции ферментов, которые участвуют в передаче сигнала для начала деления раковой клетки,
— Препараты, блокирующие образование новых сосудов в раковой опухоли, необходимых для ее роста.
Специфические иммуноглобулины
Блокаторы ферментов
Блокаторы ферментов – это химические вещества, которые останавливают какую-то основную химическую реакцию канцерогенеза путем подавления фермента, с помощью которого одно вещество превращается в другое. Результатом становится торможение роста раковых клеток. Иными словами, блокаторы ферментов вторгаются в метаболизм раковой клетки и разрывают цепочку биохимических реакций, необходимых для ее развития. В итоге деление мутировавшей клетки останавливается и она погибает. К блокаторам ферментов относят такие препараты, как Гливек (Иматиниб), Иресса (Гефитиниб), Кризотиниб, Бортезониб, Тарцева (Эрлотиниб).
Препараты, блокирующие образование новых сосудов в раковой опухоли, необходимых для ее роста
Чтобы расти и развиваться, раковой опухоли нужен постоянный приток крови, для чего новообразование формирует вокруг обширную сеть видоизмененных кровеносных сосудов. Вещества, входящие в состав препаратов таргетной терапии, препятствуют образованию таких сосудов. Хорошие результаты при лечении рака легких показывают тактие препараты, как Авастин и Талидомид.
Использование таргетной терапии для лечения рака легких
Таргетная терапия для лечения больных с раком легких может применяться как самостоятельно, так в сочетании с другими способами лечения. Во втором случае она позволяет сократить дозу необходимых химиопрепаратов или лучевую нагрузку на организм больного. Таргетная терапия при раке легких применяется:
— после основного лечения с профилактической целью для предупреждения рецидивирования патологии,
— для контролирования процесса метастазирования.
Препараты таргетной терапии, как правило, используются в таблетированном виде, что облегчает процесс лечения, не обязывая пациентов постоянно находиться в клинике. Помимо этого, низкая токсичность препаратов не вызывает существенных побочных эффектов и не требует постоянного наблюдения за состоянием здоровья (контроля давления, показателей крови и пр.).
Перспективы таргетной терапии рака легких
В настоящее время использование таргетной терапии рака легких возможно только для той группы пациентов, у кого найдены определенные виды мутагенеза, поддающиеся лечению уже имеющимися препаратами.
Сегодня биохимики всего мира продолжают изучать молекулярно-генетические особенности клеток разных типов опухолей при раке легких и разрабатывают новые лекарства. Это дает надежду, что в ближайшее время список показаний для назначения таргетных препаратов будет расширен.
Кроме того, с каждым годом растет возможность подходить к лечению более индивидуально, назначая каждому пациенту целевое лечение после тщательного биомолекулярного анализа его опухоли. Согласно прогнозам специалистов, развитие таргетной терапии в ближайшем будущем позволит значительно увеличить процент излечившихся от рака легких даже при запущенных формах.
Где можно осуществить терапию рака легких?
На нашем сайте представлено много зарубежных медицинских учреждений, готовых на высоком уровне оказать качественную медицинскую помощь по лечению рака легких. Это могут быть, например, такие клиники, как:

Китайская клиника Clifford имеет в своём составе Онкологический центр, предоставляющий услуги по лечению злокачественных опухолей. Специалисты центра используют в терапии рака как традиционные, так и альтернативные методы лечения, в частности, Integrative Green Therapy, озонотерапию и пр. Перейти на страницу >>

Израильский Медицинский центр им. Эдит Вольфсон долгое время занимается вопросами диагностики и лечения различных онкологических заболеваний. В клинику обращаются за лечением пациенты, страдающие раком почек, молочной железы, раком легких, опухолями желудка, пищевода и кишечника, раком крови. Перейти на страницу >>

Израильский центр Герцлия Медикал применяет для лечения онкологических заболеваний только передовые технологии, применяя при этом новейшее медицинское оборудование. В центре широко используют протонную терапию, брахитерапию и другие современные методики лечения и диагностики злокачественных опухолей. Перейти на страницу >>

Университетская клиника одного из крупнейших городов Германии — Дрездена — большое внимание уделяет проблемам, связанным с лечением рака. В клинике функционирует специализированный онкологический центр, где осуществляется научно-исследовательская работа и проводится обучение врачей-онкологов. Перейти на страницу >>

Университетская клиника Мюнхена LaKUMed в Германии считает одной из своих главных задач диагностику и лечение различных онкологических заболеваний. Созданное при клинике Онкологическое отделение обладает наградой от Министерства здравоохранения Германии за высокие достижения в области онкологии. Перейти на страницу >>

Медицинский центр ЕzraMed в Израиле считает лечение злокачественных новообразований одним из приоритетных направлений в своей работе. В распоряжении врачей центра есть передовое оборудование и самые современные методики для эффективной терапии практически любых онкологических заболеваний. Перейти на страницу >>

Израильский Медицинский центр Асаф-ха-Рофэ считает лечение злокачественных опухолей одним из важнейших направлений в своей деятельности. Врачи клиники обладают как высокой квалификацией, так и многолетним успешным опытом лечения разнообразных онкологических заболеваний любой сложности. Перейти на страницу >>
Каким должно быть питание при онкологических заболеваниях? Какие продукты абсолютно противопоказаны при той или иной форме рака?
Фитотерапия способна оказать существенную помощь не только в лечении онкологических заболеваний, но также и в их профилактике.
Многих людей, имеющих у себя или у родственников онкологическое заболевание, интересует вопрос: передается ли рак по наследству?
Лечение рака во время беременности является довольно сложным, ведь большинство лекарственных средств обладает токсичностью.
Какие перспективы у беременности после перенесенного онкологического заболевания? Следует ли выдерживать срок после лечения рака?
Профилактика является важной частью общей борьбы с онкологическими заболеваниями. Как же уменьшить вероятность возникновения рака?
Что представляет из себя паллиативное лечение рака? Как оно может повлиять на качество жизни онкологического больного и изменить ее к лучшему?
Учеными разработано достаточно много перспективных методов лечения рака, пока еще не признанных официальной медициной. Но все может измениться!
Как найти силы для борьбы с раком? Как не впасть в отчаяние от возможной инвалидности? Что может послужить надеждой и смыслом жизни?
Бытует такое мнение, что постоянные стрессовые ситуации способны привести к развитию онкологических заболеваний. Так ли это?
Многие онкологические больные часто страдают от резкой потери веса. Чем это вызвано и можно ли как-то справиться с этой проблемой?
Правила ухода за больными, вынужденными постоянно находиться в кровати, имеют свои особенности и их нужно обязательно знать.

Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
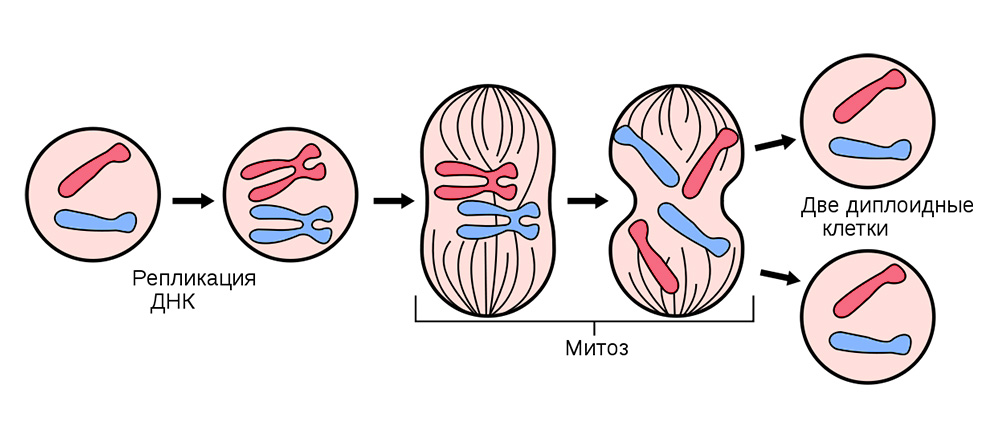
Деление соматических клеток происходит во всех органах и тканях
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
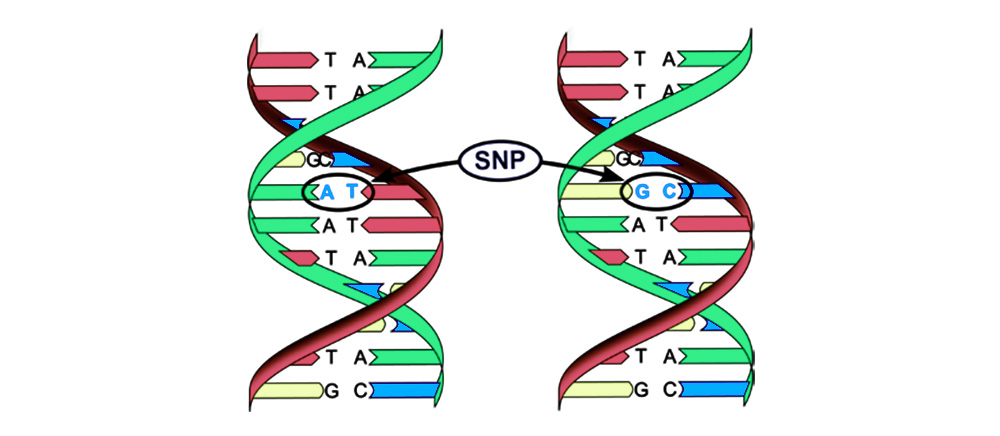
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
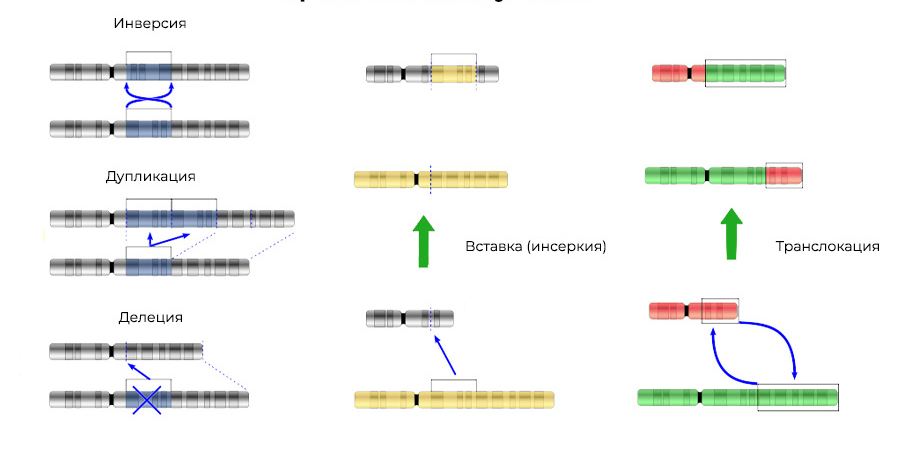
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
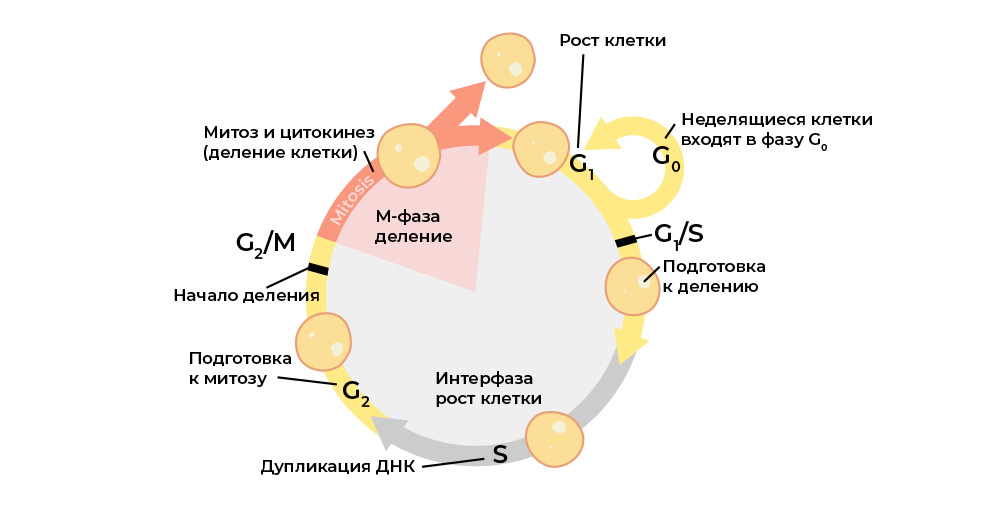
Каждый этап клеточного цикла контролируется белками-регуляторами
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
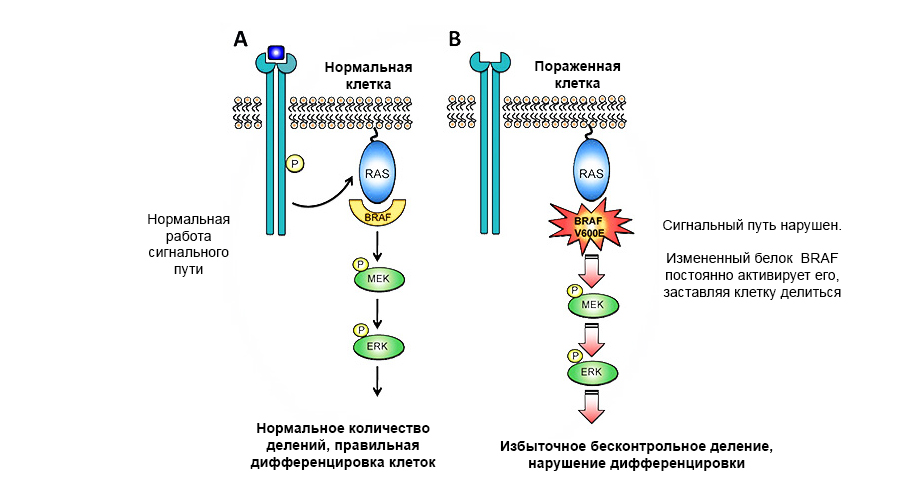
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
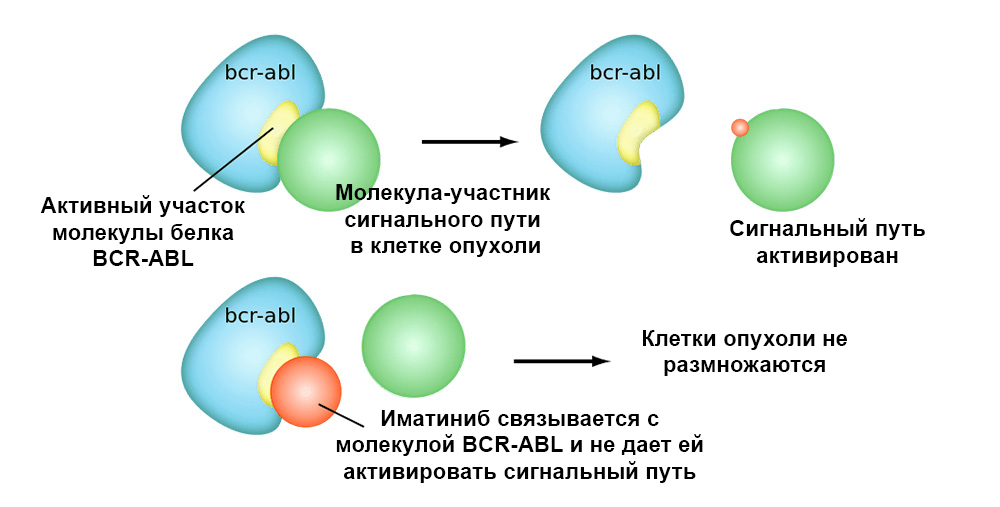
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
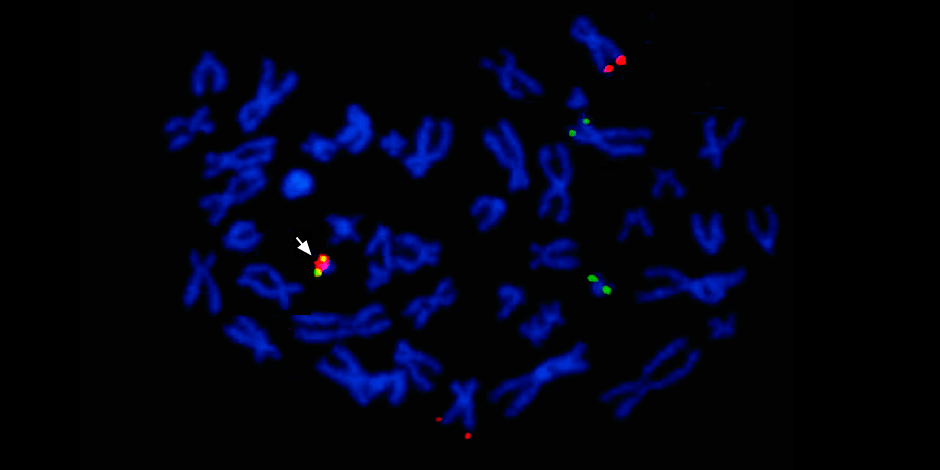
Под стрелкой слева – слияние красного и зеленого сигнала – свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.

-
4 минут на чтение

При диагностировании онкологического заболевания, поражающего легкие, в последнее время все больше специалисты стали применять таргетную терапию. Это новый вид лечения рака, который считается альтернативой химиотерапии. Данная разновидность лечения подразумевает использование нескольких категорий медикаментозных средств, направленных на подавление роста и дальнейшего распространения атипичных клеточных структур.
Описание метода
Таргетная терапия при раке легкого – это наиболее перспективная инновационная технология в борьбе с онкозаболеванием. Данная разновидность лечения относится к консервативным и отличается меньшим проявлением побочных действий по сравнению с химиотерапевтическим лечением.
Благодаря этой методике у специалистов появилась возможность продлить жизнь больным, у которых диагностирована запущенная стадия злокачественного процесса.
В результате использования таргетных препаратов опухолевое образование значительно замедляет свой рост и не дает метастазов на рядом расположенные анатомические структуры. Кроме того, отмечается такой момент, что постепенно начинают погибать уже сформировавшиеся патологические клетки.

Наталья Геннадьевна Буцык- 5 декабря 2019 г.
В зависимости от применяемого препарата, механизм его воздействия будет несколько отличаться. Другими словами, каждый медикамент направлен на поражение определенной мишени, которая занимает не последнее место в образовании и прогрессировании опухоли.
Таргетная терапия может назначаться в качестве самостоятельной тактики или дополнительно к другим терапевтическим методам. Во втором случае это дает возможность уменьшения дозировки химиопрепаратов или снижения нагрузки при лучевом облучении.
Медикаменты
Все применяемые лекарственные препараты классифицируются по группам в зависимости от их действия на раковые клетки.
Чтобы опухоль росла, ей необходимо постоянное поступление питательных веществ и кислорода. Ингибиторы ангиогенеза предназначены для блокирования образования новых сосудов и остановки дальнейшего развития злокачественного образования.
К таким препаратам относят следующие.
Представляет собой аналог иммунных белковых соединений, действие которых нацелено на рост сосудистого эндотелия VEGF. В результате происходит блокировка выработки белка, который участвует в процессе формирования сосудистых клеток.
В его составе присутствуют антитела, которые воздействуют на рецепторы VEGF. На фоне их отсутствия также невозможно дальнейшее распространение опухоли.
Назначают данный медикамент в том случае, когда отмечается положительный результат от применения других видов медикаментозных средств. Часто они используются в комбинации с химиотерапевтическими препаратами.
В нормальном состоянии белок, расположенный на поверхности клеточных структур, способствует их бесперебойному делению. Однако в некоторых клетках может присутствовать избыточное количество рецепторов, в результате чего деление происходит более стремительными темпами.
Ингибиторы EGFR – это недавно появившаяся группа медикаментов, направленных на блокирование сигнала роста и его замедление.
К наиболее распространенным лекарствам этой категории относятся Гефитиниб, Эрлотиниб, Афатиниб.


Ольга Владимировна Хазова- 5 декабря 2019 г.
Чаще всего они назначаются в качестве первой линии терапии рака легкого немелкоклеточного типа при мутировании гена EGFR. В большинстве случаев данная форма заболевания диагностируется у некурящего населения и у женщин.
Эрлотиниб также может применяться на более поздних стадиях патологии с отсутствием мутированного рецептора, когда химиотерапия не дает положительного результата.
Действие препаратов данной группы способствует сокращению размеров опухолевого образования в течение нескольких месяцев. Однако после определенного периода времени их эффект заканчивается. Основным провоцирующим фактором этого выступает новая мутация T790M.
Среди более востребованных средств выделяют Осимертиниб.
В данную группу входит Нецитумумаб. Это моноклональные антитела. Применяются при немелкоклеточном раке в сочетании с химиотерапевтическими препаратами.
Согласно статистическим данным, у пяти процентов больных может выявляться перегруппировка гена. В большинстве случаев такое происходит при формировании аденокарциномы у пациентов, которые не курят или у малокурящих.
На фоне такого состояния начинает вырабатываться аномальный белок, который способствует увеличению активности и роста онкологического новообразования.
Среди современных ингибиторов специалисты выделяют Бригатиниб, Кризотиниб, Алектиниб и Церитиниб.


Ольга Владимировна Хазова- 29 ноября 2019 г.
Они могут применяться после проведения химиотерапии или вместо нее, когда перегруппировка в гене ALK была полностью подтверждена.
Как правило, назначается медикамент в форме таблеток.
В некоторых случаях при развитии рака легкого могут начать мутировать гены МЕК и BRAF. В таких ситуациях предпочтение отдается Траметинибу и Дабрафенибу.
Показания
В большинстве случаев таргетная терапия назначается с целью профилактики после проведения основного лечения, чтобы предупредить повторное развитие болезни.
Кроме того, показанием к применению такой методики является контроль за процессом распространения метастазов на другие анатомические структуры.
Противопоказания
Несмотря на эффективность и популярность данной разновидности лечения, оно имеет некоторые ограничения к назначению. Таким образом, таргетная терапия не применяется по отношению к детям, которые не достигли 18-летнего возраста, в случае наличия аллергической реакции или повышенной чувствительности к отдельным компонентам препаратов, при развитии кишечной непроходимости.
Кроме того, противопоказанием является печеночная и сердечная недостаточность, а также беременность и грудное вскармливание.
К относительным ограничениям также относят проведение хирургического вмешательства. В таких ситуациях применение данного вида терапии недопустимо в течение одного месяца после операции.
Однако, если есть серьезные медицинские показания, то врач может принять решение об использовании лечения при помощи молекулярно-направленных медикаментозных препаратов.
Плюсы терапии
Среди основных преимуществ применения таргетных препаратов при раке легких выделяют в первую очередь возможность точечно воздействовать на клеточные структуры онкологического новообразования.
Также отмечается хорошая переносимость большинства тяжелых больных и минимальные проявления побочных эффектов.
Кроме того, не менее важным положительным моментом является возможность применять таргетную терапию в совокупности с другими методами лечения рака.

Наталья Геннадьевна Буцык- 29 ноября 2019 г.
Благодаря тому, что практически все медикаменты выпускаются в таблетированном виде, можно лечиться в домашних условиях.
Также при прохождении лечения не возникает необходимость в смене привычного образа жизни. Допускается физический труд и ведение активного образа жизни.
Побочные эффекты
При проведении таргетной терапии при помощи медикаментозных средств могут начать проявляться различные негативные реакции. Однако подобные состояния легко переносятся пациентами и не причиняют серьезного вреда человеческому организму.
Среди наиболее распространенных последствий выделяют повышенное раздражение и усталость, нестабильность показателей давления, отечность слизистых, расстройства на диспептическом уровне, отсутствие аппетита.
Эффективность
В настоящее время таргетная терапия применяется только при выявлении мутирования определенных генов, которые могут излечиваться при помощи уже имеющихся медикаментозных средств. Прогнозы при таком виде лечения благоприятные даже при выявлении тяжелых форм рака легких.
Таргетная терапия — это новое направление в борьбе с онкологическим заболеванием легких. Несмотря на всю эффективность и положительные прогностические данные, применять ее пока можно только при условии мутации некоторых генов. Кроме того, использование препаратов имеет определенные ограничения к применению и незначительную вероятность появления побочных эффектов.


