Синдром аспирации мекония у новорожденных
- Российская ассоциация специалистов перинатальной медицины (РАСПМ)
Оглавление
Ключевые слова
синдром мекониальной аспирации
синдром аспирации мекония
персистирующая легочная гипертензия
Список сокращений
ИВЛ – искусственная вентиляция легких
МАР – среднее давление в дыхательных путях
РКИ — рандомизированные контролируемые исследования
САМ – синдром аспирации мекония
СДР, РДС — синдром дыхательных расстройств
СРАР – continuous positive airway pressure / метод респираторной терапии – постоянное давление в дыхательных путях
УЗИ — ультразвуковое исследование
ЧСС — частота сердечных сокращений
ЭТТ – эндотрахеальная трубка
f — частота аппаратных вдохов, в минуту
fO2 — содержание кислорода в воздушной смеси
Peep – пиковое давление в конце выдоха
Pip – пиковое давление на вдохе
SpO2 — сатурация, насыщение крови кислородом, измеряемое методом пульсоксиметрии
Ti — время вдоха
раСO2 — концентрация углекислого газа в крови
раО2 – концентрация кислорода в крови
Термины и определения
Синдром аспирации мекония – тяжелое расстройство дыхания у новорожденных детей, вызванное попаданием мекония в нижние дыхательные пути.
Сурфактант (в переводе с английского – поверхностно-активное вещество) – смесь поверхностно-активных веществ, выстилающая альвеолы изнутри.
Персистирующая легочная гипертензия – состояние, характеризующееся снижением кровотока в легких новорожденного и появление при этом право-левого сброса крови в результате возврата к констрикции артериол легких или персистирования.
Тахипноэ — учащённое поверхностное дыхание.
1. Краткая информация
1.1 Определение
Синдром аспирации мекония (САМ) – тяжелое расстройство дыхания у новорожденных детей, вызванное попаданием мекония в нижние дыхательные пути.
Синонимы САМ: синдром мекониальной аспирации новорожденных, неонатальная аспирация.
1.2 Этиология и патогенез
САМ чаще наблюдается у переношенных или доношенных новорожденных, которые подверглись внутриутробной антенатальной и/или интранатальной гипоксии и родились в асфиксии, приведшей к спазму сосудов брыжейки, усилению перистальтики кишечника, расслаблению анального сфинктера и пассажу мекония — выходу его в околоплодные воды. Обвитие пуповины вокруг шеи, сдавление ее стимулирует вагусную реакцию и пассаж мекония даже при отсутствии асфиксии.
1.3 Эпидемиология
1.4 Кодирование по МКБ 10
P24.0 – Неонатальная аспирация мекония
1.5 Классификация
Классификация САМ по вариантам течения
Первый вариант — с рождения имеется тяжелая дыхательная недостаточность, приступы вторичной асфиксии, одышки, притупления легочного тона, повышение ригидности грудной клетки, обильные разнокалиберные влажные хрипы в легких.
Классификация САМ по степени тяжести
В зависимости от количества, консистенции аспирированной жидкости, а также от сроков аспирации различают:
Легкая степень – отмечается тахипноэ, проходящее через 42-72 часа. Уровень рСО2 в артериальной крови в пределах нормы, рН крови без изменений. Редко отмечается незначительная гипоксимия, корригируемая ингаляцией кислорода.
Средняя степень – клиника схожа с легкой степенью, но нарастание дыхательной недостаточности происходит быстрее и пик приходится на 24 часа. В артериальной крови отмечается гипоксимия степень, которой не соответствует тяжести легочной патологии (сопоставление с Rg-граммой грудной клетки). Это может говорить о стойкой легочной гипертензии с шунтированием крови справа налево как на уровне открытого артериального протока так и на уровне предсердий (что подтверждается УЗИ сердца с Доплер-эффектом).
Тяжелая степень – дыхательная недостаточность отмечается сразу после рождения или в первые 24 часа жизни. В данном случае отмечается сочетание дыхательного и метаболического ацидоза, которые требуют немедленной коррекции.
При тяжелой степени достаточно часто развитие таких осложнений как напряженный пневмоторакс и практически всегда развитие стойкой легочной гипертензии. Стойкость легочной гипертензии связанна в первую очередь с утолщением стенок сосудов легочных артерий вследствие их чрезмерной гипертрофии и гиперплазии. Впервые о гипертрофии сообщили Siassi и соавт. в 1971 году. В частности, в их исследовании доказывалось, что хроническая гипоксия может вызывать утолщение стенок мелких легочных артерий вследствие гипертрофии гладкой мускулатуры, что в свою очередь приводит к стойкому сужению просвета сосуда. Помимо всего выше перечисленного сейчас установлено, что острая гипоксемия плода вызывает дальнейшее сужение легочных артерий, что в итоге приводит к стойкой легочной гипертензии.
2. Диагностика
2.1 Жалобы и анамнез
Анамнез заключается в выявлении факторов риска, таких как переношенность ребенка, эклампсия беременной, гипертензия беременной, сахарный диабет беременной.
2.2 Физикальное обследование
Рекомендовано на этапе постановки диагноза начать с оценки симптомов дыхательной недостаточности у новорожденного по шкале Даунса (Приложение Г) [1].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2b)
Комментарии: Раннее (в течение 2 ч) наблюдается появление симптомов дыхательной недостаточности: тахипноэ, раздувание крыльев носа, втяжения уступчивых мест грудной клетки, цианоз. Увеличение передне-заднего размера грудной клетки.
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2b)
Комментарии: При перкуссии выявляют участки притупления, чередующиеся с коробочным звуком. Выслушивается ослабленное или жёсткое дыхание с большим количеством проводных и крепитирующих хрипов. Удлинённый выдох. Тоны сердца приглушены, можно выслушать систолический шум. Из-за нарушения периферического кровотока кожные покровы приобретают мраморный цвет, могут появиться отёки.
2.3 Лабораторная диагностика
-
Рекомендовано на этапе постановки диагноза провести анализ кислотно-основного состояния и газов крови [1]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: При САМ выявляют резко выраженную гипоксемию и смешанный ацидоз.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: Поскольку меконий может усилить рост бактерий и САМ трудно отличить от бактериальной пневмонии.
2.4 Инструментальная диагностика
-
Рекомендуется на этапе постановки диагноза провести рентгенографию органов грудной клетки для подтверждения факта аспирации [1]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1a)
2.5 Дифференциальная диагностика
Дифференциальную диагностику проводят с РДС, персистирующей лёгочной гипертензией, вызванной тяжёлой асфиксией и сепсисом, врожденной пневмонией, при состоянии средней тяжести — с преходящим тахипноэ новорождённых.
При диагностике РДС характерными признаками на рентгеновском снимке являются: диффузное снижение прозрачности легочных полей, ретикулогранулярный рисунок и полоски просветлений в области корня легкого (воздушная бронхограмма).
Диагностика транзиторного тахипноэ новорожденных. Заболевание может встречаться при любом гестационном возрасте новорожденных, но более характерно для доношенных, особенно после родоразрешения путем кесарева сечения. Заболевание характеризуется отрицательными маркерами воспаления и быстрым регрессом дыхательных нарушений. Нередко требуется проведение назального СРАР — метод создания постоянного давления в дыхательных путях. Характерно быстрое снижение потребности в дополнительной оксигенации на фоне проведения СРАР. Крайне редко требуется проведение инвазивной ИВЛ. Отсутствуют показания для введения экзогенного сурфактанта.
Диагностика раннего неонатального сепсиса, врожденной пневмонии. Характерны положительные маркеры воспаления, определяемые в динамике в первые 72 часа жизни. Рентгенологически при однородном процессе в легких ранний неонатальный сепсис/пневмония неотличимы от САМ. Однако, если процесс в легких очаговый (инфильтративные тени), то это признак характерен для инфекционного процесса и не характерен для САМ. При САМ на рентгенограмме органов грудной клетки инфильтративные тени перемежаются эмфизематозными изменениями, ателектазами, (возможны пневмомедиастинум и пневмоторакс).
Диагностика персистирующей легочной гипертензии новорожденных. На рентгеновском снимке органов грудной клетки отсутствуют характерные для САМ изменения. При эхокардиографическом исследовании выявляется право-левый сброс и признаки легочной гипертензии.
3. Лечение
3.1 Консервативное лечение
Сурфактантная терапия
При подтверждении САМ рекомендуется применение сурфактантной терапии [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: Способ сурфактант-терапии состоит в проведении лаважа трахеобронхиального дерева разведенным препаратом Порактант альфа**. Для этого препарат (75 мг во флаконе) разводят в 2,5 мл физиологического раствора, согласно инструкции фирмы производителя. Из этой эмульсии берут 0,5 мл и дополнительно разводят физиологическим раствором до 5,0 мл (осторожно перемешивая и не встряхивая) и проводят лаваж трахеобронхиального дерева дробно двумя-тремя порциями. Оставшиеся 2,0 мл (60 мг) эмульсии вводят попеременно по 1,0 мл в левый и в правый бронх болюсно через санационный катетер. Второй флакон препарата вводят микроструйно, так что общая доза составляла 50 мг / кг. Лечение синдрома аспирации мекония тяжелой степени путем проведения сурфактант-терапии в виде лаважа трахеобронхиального дерева разведенным Порактантом альфа** с последующим введением небольшой дозы препарата позволяет достоверно уменьшить время достижения нетоксической концентрации кислорода в подаваемой газовой смеси, время нахождения детей на искусственной вентиляции легких и в отделении реанимации и интенсивной терапии новорожденных. Известно, что меконий эффективно связывается с легочным сурфактантом за счет химических и физических механизмов взаимодействия и инактивирует его. При этом критерием инактивации является потеря сурфактантом свойства эффективно снижать поверхностное натяжение на границе раздела фаз воздух — вода. Меконий, сорбированный на частицах экзогенно введенного сурфактанта, удаляется при лаваже, а следующее за ним введение терапевтической дозы Порактанта альфа** 50 мг/кг выполняет роль заместительной терапии, приводя к повышению растяжимости легких, устранению ателектазов и улучшению вентиляционно-перфузионного отношения. Эффект терапии проявлялся улучшением аускультативной картины в легких и положительной динамикой на рентгенограммах грудной клетки.
Седация и миорелаксация
-
Для уменьшения потребления кислорода и исключения работы дыхания в отделении интенсивной терапии рекомендуется глубокая седация и миорелаксация [1].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2a)
Комментарии:тримеперидин** — доза насыщения — 0,5 мг/кг, поддерживающая — 20-80 мкг/(кгхч); фентанил** — доза насыщения 5-8 мкг/кг, поддерживающая доза — 1-5 мкг/(кгхч) ); пипекурония бромид # ** — 0,1 мг/кг.
Антибактериальная терапия
- Рекомендуется назначить стартовую антибактериальную терапию до получения результатов посевов [1].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2b)
Комментарии: Антибактериальная терапия показана при аспирации мекония, так как он способствует росту бактерий. Начинают с цефалоспоринов и аминогликозидов. По результатам посевов из трахеи проводят смену антибактериальной терапии.
Респираторная терапия новорожденных с САМ
Помощь новорожденному с САМ в родильном зале
- Рекомендуется оказание помощи в родильном зале всем новорожденным с САМ [2].
Уровень убедительности рекомендаций В (уровень достоверности доказательств–2b)
Комментарии: Широкое использование в предыдущие годы санации носо- и ротоглотки плода до рождения плечиков с профилактической целью не подтвердило своей эффективности, поэтому в настоящее время эта манипуляция не рекомендована для рутинного применения. Санация носо- и ротоглотки ребенка должна быть проведена после перемещения ребенка на реанимационный столик. При этом, несмотря на то, что околоплодные воды содержат меконий, если у ребенка сразу после рождения отмечается хороший мышечный тонус, активное самостоятельное дыхание или громкий крик, то санация трахеи не показана.
Если околоплодные воды содержат меконий и у ребенка отмечается сниженный мышечный тонус, неэффективное или ослабленное самостоятельное дыхание, сразу после рождения необходимо провести интубацию трахеи с последующей санацией через эндотрахеальную трубку. Следует обратить особое внимание на то, что санация проводится путем подключения шланга аспиратора через Т-образный коннектор или мекониальный аспиратор непосредственно к эндотрахеальной трубке. Санация производится до полной аспирации содержимого трахеи. Если эндотрахеальная трубка блокирована меконием, следует удалить эту трубку, повторно интубировать трахею ребенка и продолжить санацию. Использование с этой целью аспирационных катетеров, диаметр которых всегда меньше, чем диаметр эндотрахеальной трубки, не допускается. Если на фоне санации отмечается нарастание брадикардии менее 80уд/мин, санацию следует прекратить и начать искусственную вентиляцию легких (ИВЛ) до повышения частоты сердечных сокращений (ЧСС) более 100 уд/мин. Вопрос о необходимости повторной санации трахеи решается после восстановления сердечной деятельности ребенка в индивидуальном порядке.
Использование ИВЛ в условиях родильного зала
Рекомендуется начать ИВЛ сразу после извлечения ребенка из матери [2].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2a)
Комментарии: Использование саморасправляющегося мешка у новорожденных:
Следует использовать саморасправляющийся мешок объемом не более 240 мл. Такой размер более чем достаточен для проведения вентиляции легких у новорожденных. После сжатия мешок расправляется самостоятельно за счет своих эластических свойств, независимо от источника газовой смеси, что делает использование этого устройства удобным и простым. Однако, для проведения ИВЛ воздушно-кислородной смесью, необходимо подключить мешок к источнику кислорода и установить скорость потока 8 л/мин. Такая скорость позволяет добиться концентрации в дыхательной смеси около 40%. Для создания более высокой концентрации кислорода (80-90%) к саморасправляющемуся мешку требуется подключить дополнительно кислородный резервуар. Следует помнить, что при проведении ИВЛ с помощью саморасправляющегося мешка трудно поддерживать одинаковое пиковое давление от вдоха к вдоху. Поэтому целесообразно использовать манометр, подключенный к мешку. Максимальное пиковое давление ограничено клапаном сброса избыточного давления, который срабатывает при превышении около 40 смН2O. Для создания большего давления на вдохе следует заблокировать пальцем клапан сброса давления. Иногда это может потребоваться при неэффективности первых принудительных вдохов в процессе масочной ИВЛ у крупных доношенных новорожденных. При использовании саморасправляющегося мешка невозможно создать положительное давление в конце выдоха, не подключив дополнительно клапан, создающий давление в конце выдоха. Использование саморасправляющегося мешка не позволяет обеспечить раздувание легких длительностью более одной секунды.
Использование аппарата ИВЛ с Т-коннектором:
В аппаратах ИВЛ с Т-коннектором газовая смесь поступает в маску или интубационную трубку через контур, подключенный к смесителю сжатого воздуха и кислорода и к манометру. Вентиляция обеспечивается благодаря окклюзии пальцем выходной трубки Т-коннектора, осуществляемой с определенной периодичностью. Аппарат позволяет создавать и регулировать необходимое давление, как на вдохе, так и при помощи изменения диаметра отверстия выходной трубки на выдохе (СРАР, PEEP). Время вдоха регулируется путем изменения длительности окклюзии пальцем выходной трубки Т-коннектора. Для функционирования устройства требуется подключение его к источнику газовой смеси. Скорость потока устанавливается 8 л/мин. По сравнению с саморасправляющимся и поточнорасправляющимся мешками устройства с Т-коннектором являются наиболее удобными для проведения ИВЛ у новорожденных детей в родильном зале.
ИВЛ как метод респираторной терапии новорожденных с САМ
- При выраженных признаках дыхательной недостаточности, подтвержденной на рентгенограмме САМ, рекомендуется начать ИВЛ [4].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1b)
Комментарии: Умеренную гипоксемию можно корригировать ингаляцией увлажненного кислорода через кислородную палатку. Эффект от применения СРАР у новорождённых с САМ непредсказуем и поэтому его не рекомендуют для рутинного использования.
Показания к ИВЛ: 1) рефрактерная гипоксемия — ра02 0,9; 2) респираторный ацидоз — раС02 >60, рН

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Аспирация мекония в родах может вызвать развитие химического пневмонита и механической бронхиальной обструкции, в результате чего развивается дыхательная недостаточность. При обследовании выявляют тахипноэ, хрипы, цианоз или десатурацию.
Диагноз подозревают, если после родов при наличии окрашенных меконием околоплодных вод у ребенка развивается дыхательная недостаточность, подтверждается диагноз при рентгенографии грудной клетки. Лечение аспирации мекония в родах включает отсасывание содержимого изо рта и носа сразу после родов до того, как ребенок сделает первый вдох, после чего при необходимости проводится респираторная поддержка. Прогноз зависит от лежащих в основе физиологических стрессорных механизмов.

[1], [2], [3], [4], [5], [6]
Причины аспирации мекония в родах
Физиологический стресс во время родовой деятельности и родов (из-за гипоксии, вызванной сдавлением пуповины или плацентарной недостаточностью или инфекцией) может вызвать отхождение мекония в амниотическую жидкость до рождения ребенка; отхождение мекония отмечают примерно в 10-15 % родов. Во время родов около 5 % детей, у которых отошел меконий, аспирируют меконий, провоцируя повреждение легких и развитие дыхательной недостаточности, что называется синдромом аспирации мекония.
Переношенные дети, рождающиеся в условиях маловодия, подвержены риску более тяжелых форм заболевания, потому что менее разведенный меконий более часто вызывает обструкцию дыхательных путей.
- преэклампсия, эклампсия;
- артериальная гипертензия;
- перенашивание беременности;
- сахарный диабет у матери;
- снижение двигательной активности плода;
- задержка внутриутробного развития;
- курение матери;
- хронические заболевания лёгких, сердечно-сосудистой системы.
Механизмы, благодаря которым аспирация индуцирует развитие клинического синдрома, вероятно, включают выброс цитокинов, обструкцию дыхательных путей, инактивацию сурфактанта и/или химический пневмонит; лежащие в основе физиологические стрессоры также могут иметь значение. Если возникает полная бронхиальная обструкция, в результате развивается ателектаз; частичная блокада ведет к возникновению воздушной ловушки, когды при вдохе воздух поступает в
альвеолы, а при выдохе не может выйти, что приводит к перерастяжению легких и возможному появлению пневмоторакса с развитием пневмомедиастенума. Продолжающаяся гипоксия может привести к персистирующей легочной гипертензии новорожденных.
Также во время родов младенцы могут аспирировать первородную смазку, амниотическую жидкость или кровь матери или плода, после чего может развиться дыхательная недостаточность и признаки аспирационной пневмонии на рентгенографии грудной клетки.
Лечение поддерживающее; если подозревают бактериальную инфекцию, следует произвести посевы и начать антибактериальную терапию.
Гипоксия и другие формы внутриутробного стресса плода провоцируют усиление перистальтики кишечника, расслабление наружного анального сфинктера и отхождение мекония. С увеличением гестационного возраста этот эффект усиливается. Именно поэтому при окрашивании ОПВ меконием в случае рождения недоношенного ребёнка следует считать, что он перенёс более тяжёлую гипоксию, чем переношенный новорождённый.
В развитии аспирационной пневмонии играют роль два фактора: бактериальный — за счет низкого бактерицидного эффекта механических ОПВ — и химический — вследствие механического воздействия на слизистую оболочку бронхиального дерева (пневмонит). Возникает отёк бронхиол, сужается просвет мелких бронхов. Неравномерная вентиляция лёгких вследствие образования участков с частичной обструкцией дыхательных путей и присоединившаяся пневмония вызывают выраженную гиперкапнию и гипоксемию. Гипоксия, ацидоз и вздутие лёгких вызывают увеличение сосудистого сопротивления в лёгких. Это приводит к право-левому шунтированию крови на уровне предсердий и артериального протока и дальнейшему ухудшению насыщения крови кислородом.
Симптомы аспирации мекония в родах
Симптомы аспирации мекония могут быть различными, это зависит от тяжести гипоксии, количества и вязкости аспирированных околоплодных вод. Как правило, дети рождаются с низкой оценкой по шкале Апгар. В первые минуты и часы жизни отмечают угнетение функций ЦНС, связанное с перенесённой перинатальной гипоксией.
Аспирация большого количества околоплодных вод у новорождённого вызывает острую обструкцию дыхательных путей, которая проявляется глубокими судорожными вдохами, цианозом и нарушениями газообмена.
При благоприятном течении даже в случае массивной аспирации рентгенограмма нормализуется ко 2-й нед, но повышенная пневматизация лёгких, участки фиброза, пневматоцеле могут сохраняться несколько месяцев. Летальность при аспирации мекония в случае несвоевременной санации трахеобронхиального дерева достигает 10% за счёт осложнений (утечки воздуха, инфекции).
Симптомы аспирации мекония включают тахипноэ, раздувание крыльев носа, втяжение податливых мест грудной клетки, цианоз и снижение сатурации, хрипы и зеленовато-желтое окрашивание пуповины, ногтевого ложа и кожи. Мекониальное окрашивание может быть заметно также и в области ротоглотки и (при интубации) в гортани и трахее. Новорожденные с развитием воздушной ловушки могут иметь бочкообразную грудную клетку, а также симптомы и признаки пневмоторакса, интерстициальной эмфиземы легких и пневмомедиастинума.
Диагностика аспирации мекония в родах
Диагноз подозревают, если у новорожденного имеются признаки дыхательной недостаточности при родах с мекониальным окрашиванием околоплодных вод, и подтверждают при рентгенографии грудной клетки, обнаруживая гипервентиляцию с областями ателектазов и уплощение диафрагмы. Можно увидеть жидкость в междолевых областях и плевральной полости, а также обнаружить воздух в мягких тканях и средостении. Так как меконий может провоцировать размножение бактерий, а синдром мекониальной аспирации сложно отличить от бактериальной пневмонии, следует также провести посевы крови и аспирата из трахеи.

[7], [8], [9]
Лечение аспирации мекония в родах
Неотложное лечение, показанное всем новорожденным при окрашивании околоплодных вод меконием, включает энергичное отсасывание содержимого изо рта и носоглотки с использованием аппарата Де Ли сразу после прорезывания головки и до того, как ребенок сделает первый вдох и закричит. Если при отсасывании нет следов мекония в содержимом, а ребенок выглядит активным, показано наблюдение без дальнейшего вмешательства. Если у ребенка затрудненное дыхание или отмечается угнетение дыхания, мышечный тонус снижен или отмечается брадикардия (менее 100 уд/мин), следует провести интубацию трахеи трубкой 3,5 или 4,0 мм. Аспиратор мекония, соединенный с электроотсосом, подсоединяется непосредственно к интубационной трубке, которая в дальнейшем служит как катетер для отсоса. Отсасывание продолжается, пока удаляют интубационную трубку. Повторная интубация и СДППД показаны при сохраняющейся дыхательной недостаточности, после при необходимости ребенка переводят на ИВЛ и помещают в отделение интенсивной терапии. Поскольку СДППД увеличивает риск пневмоторакса, регулярные осмотры (включая физикальное обследование и рентгенографию грудной клетки) важно проводить для обнаружения этих осложнений; о них следует в первую очередь думать у детей с интубацией трахеи, чье артериальное давление, микроциркуляция или сатурация кислорода внезапно ухудшаются.
Дополнительное лечение аспирации мекония в родах может включать сурфактанту детей на ИВЛ с высокой потребностью в кислороде, который может снизить необходимость в экстракорпоральной мембранной оксигенации. Антибактериальная терапия показана при аспирации мекония, так как он способствует росту бактерий. Начинают с цефалоспоринов и аминогликозидов. Нередко у детей с аспирацией мекония в первые сутки жизни отмечают лёгочную гипертензию, гиповолемию, патологический ацидоз, гипогликемию, гипокальциемию и т.д. Необходим контроль уровня гликемии, показателей кислотно-основного состояния (КОС), ЭКГ, артериального давления, основных электролитов с последующей их коррекцией. Как правило, в первые сутки детей не кормят; со 2-го дня жизни желательно начать энтеральное питание с помощью соски или зонда в зависимости от тяжести состояния. При невозможности энтерального кормления проводят инфузионную терапию.
Лечение синдрома утечки воздуха, осложнения воздушной ловушки, обсуждается ниже.
Профилактику начинают с выявления вышеизложенных предрасполагающих факторов и их коррекции. Во время родов при высоком риске гипоксии плода проводят мониторинг состояния плода. Если результаты оценки свидетельствуют о критическом состоянии плода, показано родоразрешение наиболее приемлемым способом (кесарево сечение, акушерские щипцы).
Диспансерное наблюдение детей, перенёсших аспирацию мекония, осуществляют участковый педиатр (1 раз в месяц), невролог и окулист (1 раз в 3 мес).

[10], [11], [12]
Этот синдром является самостоятельной нозологией. Преимущественно аспирация мекония наблюдается у переношенных или доношенных детей, подвергшихся длительной внутриутробной или острой интранатальной гипоксии. Это приводит к спазму сосудов брыжейки, усилению перистальтики кишечника, расслаблению анального сфинктера и выходу мекония в околоплодные воды. Это возможно даже при отсутствии асфиксии — при обвитии пуповины вокруг шеи, сдавлении ее, что стимулирует вагусную реакцию и выход мекония. В этой статье мы расскажем о том, что такое аспирация мекония у новорожденных — синдром, последствия.
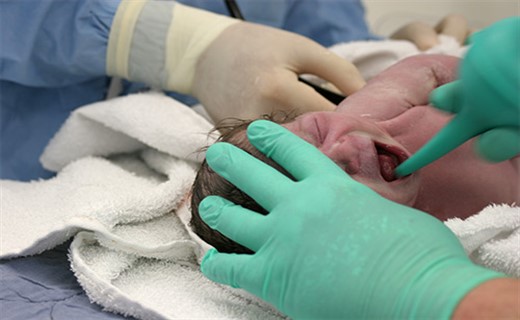
Что собой представляет аспирация меконием?
Частота окрашивания околоплодных вод меконием колеблется от 8 до 20% от общего числа родов. У 50% из этих детей меконий обнаруживается в трахее и бронхах, но только у 1/3 новорожденных развивается синдром аспирации мекония.
Гипоксия и другие формы внутриутробного стресса плода вызывают усиление перистальтики кишечника, расслабление наружного анального сфинктера и отхождение мекония.
Первые дыхательные движения плода обнаруживаются уже на 11 неделе гестационного периода. Периоды дыхания редко длятся более 10 минут и чередуются с апноэ продолжительностью до 1-2 часов. Гипоксия приводит к появлению преждевременных глубоких «вздохов», во время которых мекониальные околоплодные воды попадают в дыхательные пути. Перемещение мекония в дыхательные пути малого калибра происходит быстро, в течение часа после рождения.
Патогенез дыхательных расстройств при синдроме аспирации, в первую очередь, связан с нарушением проходимости дыхательных путей и механическим препятствием заполнению легких воздухом. При этом в любом отделе респираторного тракта может возникнуть полная или частичная обструкция с развитием клапанного механизма. При полной обструкции дыхательных путей воздух не может проникнуть в нижележащие отделы, в результате чего возникает коллабирование участков легкого с образованием субсегментарных ателектазов. Клапанный механизм обструкции заключается в том, что при вдохе воздух, обтекая препятствие, попадает в дистальные отделы респираторного тракта, а при выдохе препятствие полностью перекрывает просвет бронха и не дает воздуху выйти, поскольку просвет мелких воздухоносных путей увеличивается при вдохе и уменьшается при выдохе.
Задержка и накопление воздуха ниже места обструкции приводит к перерастяжению альвеол, образованию «воздушных ловушек» и эмфиземы. В результате снижается растяжимость легких, ухудшаются вентиляционно-перфузионные отношения, увеличиваются внутрилегочное шунтирование и сопротивление дыхательных путей. На фоне усиленного дыхания и неравномерной вентиляции может произойти разрыв альвеол, ведущий к утечке воздуха из легких.
Кроме механической обструкции, присутствие мекония, содержащего желчные соли и активные протеолитические ферменты, является причиной химического воспаления бронхиального и альвеолярного эпителия. Это создает предпосылки для развития бактериальной флоры и прогрессирования трахеобронхита и пневмонии.
Неравномерная вентиляция, нарушение вентиляционно-перфузионных отношений и присоединившийся пневмонит приводят к развитию гипоксемии, гиперкапнии и ацидоза.
При возникновении гипоксии и ацидоза развивается выраженный спазм легочных сосудов, что приводит к развитию вторичной легочной гипертензии. Величина давления в легочной артерии может достигать уровня системного и даже превышать его. Фетальные коммуникации не закрываются, а напротив, усиливается шунтирование крови через артериальный проток и овальное окно. Шунт крови справа — налево может достигать 70 — 80%.
Легочная гипертензия, в свою очередь, оказывает отрицательное влияние на функцию правого, а затем и левого желудочков сердца. Острое увеличение постнагрузки правого желудочка сопровождается уменьшением фракции изгнания, что ведет к снижению преднагрузки левого желудочка и сердечного выброса.
По данным различных акушерских стационаров, присутствие мекония в околоплодных водах регистрируется в 2 — 10% случаев, однако синдром массивной мекониальной аспирации (MAC) встречается в 5 — 10 раз реже.
Чем опасна аспирация мекония у новорожденных?
Аспирированный меконий вызывает воспалительную реакцию в трахее, бронхах, легочной паренхиме за счет содержащихся в нем липидов, протеолитических ферментов и его повышенной осмолярности. Возникают также обструкция глубоких дыхательных путей, «воздушные ловушки», ателектазы из-за закупорки бронхов и инактивации сурфактанта, что приводит к спадению альвеол на выдохе. Помимо химического воспаления и ателектазов, в легких возникает отек, перифокальная эмфизема с развитием легочной гипертензии, пневмоторакс и другие виды «утечки воздуха».
Результаты последних исследований выявили высокое содержание в крови новорожденных с мекониальной аспирацией иммунореактивного эндотелина-1, который обладает выраженным сосудосуживающим эффектом, что способствует развитию легочной гипертензии и гиперреактивности легочных сосудов. Летальность при тяжелых формах мекониальной аспирации до недавнего времени составляла 50%. В настоящее время за счет совершенствования методов первичной реанимации и использования, в необходимых случаях, ВЧО ИВЛ летальность значительно снизилась.
Если меконий густой, в виде глыбок, следует очистить от него нос и ротоглотку новорожденного ещё до того, как грудная клетка выйдет из родового канала. Сразу же после рождения, как и при аспирации околоплодных вод, производят эндотрахеальную интубацию и отсасывают содержимое из трахеи до полного её очищения. Удаление заглоченного мекония из желудка предупреждает повторную аспирацию. Всем детям проводят оксигенотерапию, иногда вплоть до длительной искусственной вентиляции легких (в тяжёлых случаях). Мекониальная аспирация новорожденных лечится антибиотикотерапией.
Дети с синдромом аспирации мекония
Как правило, новорожденные рождаются с низкой оценкой по шкале Апгар. У переношенных детей часто имеется прокрашивание меконием ногтей, кожи, пуповины.
Существует два варианта клинического течения мекониальной аспирации:
- С рождения у многих детей отмечаются признаки дыхательных расстройств, у части — приступы вторичной асфиксии, притупление легочного звука, повышение ригидности грудной клетки, обильные разнокалиберные влажные хрипы в легких.
- У части детей после рождения имеется «светлый» промежуток, после которого (по мере продвижения мелких частиц мекония к мелким бронхам) возникает клиника тяжелой дыхательной недостаточности. В наиболее тяжелых случаях мекониальная аспирация осложняется синдромом персистирующей легочной гипертензии (ПЛГ), при ИВЛ частым нередким осложнением является синдром «утечки воздуха». Через 24-48 часов большинство детей развивают клинику аспирационной пневмонии.
Диагностика
Чтобы диагностировать синдром аспирации мекония у новорожденных, врачам нужно провести тщательный анализ клинико-анамнестических данных. После этого необходима рентгенограмма легких, выявляющая сочетание крупных участков затемнения, отходящих от корней легких, с участками эмфизематозных вздутий. Характерен симптом «снежной бури», кардиомегалия, реже — пневмоторакс. Диафрагма уплощена, переднезадний размер грудной клетки увеличен. Если в мекониальных водах обнаружены плотные фрагменты мекония, то вероятность мекониальнои аспирации и пневмонии гораздо выше, чем тогда, когда околоплодные воды просто окрашены меконием.
Лечение
Необходимо раннее отсасывание мекония из дыхательных путей сразу после рождения до начала вспомогательной вентиляции легких (Приложение 1 к Приказу МЗ РФ №372). Удалив содержимое желудка, интубируют трахею и проводят отсасывание мекония из нее, промывают трахею 1-2 мл стерильного изотонического раствора хлорида натрия и отсасывают. Затем начинают ИВЛ в течение 1-2 минут и снова повторяют процедуру промывания «до получения светлых вод» каждые 30 минут в первые 2 часа жизни. Интенсивность и длительность респираторной терапии, а также особенности поддерживающей терапии, зависят от тяжести клинической картины и имеют много общего с РДС. Из-за высокого риска пневмонии всем детям с синдромом аспирации мекония необходимо раннее назначение антибиотикотерапии.
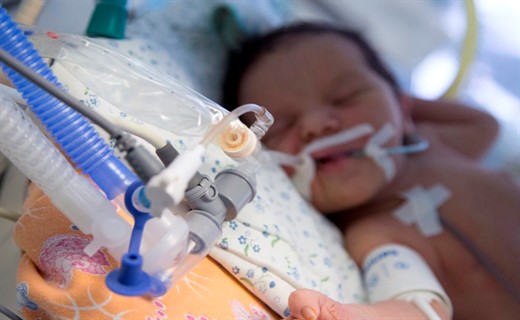
Искусственная вентиляция легких
В первые двое суток ее обычно проводят в контролируемом режиме с частотой 50-70 вдохов в 1 минуту, максимальным давлением на вдохе 25-30 см вод. ст. и положительным давлением в конце выдоха +3-4 см вод. ст. Для предотвращения задержки воздуха в легких и развития эмфизематозных участков отношение времени вдоха к выдоху не должно быть больше, чем 1:2. При наличии симптомов легочной гипертензии оправдано поддержание умеренной гипервентиляции с уровнем PaCO2 — 33-30 мм рт. ст.
Для синхронизации дыхания ребенка с работой респиратора в этот период обязательно используются седативные препараты, центральные анальгетики и миорелаксанты (реланиум в дозе 0,5 мг/кг, промедол — 0,2-0,4 мг/кг, ардуан — 0,04-0,06 мг/кг).
Дефицит циркулирующей крови у новорожденных с мекониальной аспирацией чаще всего связан с уменьшением плазменного объема. Поэтому в состав препаратов для инфузионной терапии включают плазму из расчета 10-15 мл/кг.
Если несмотря на восполнение дефицита ОЦК у ребенка сохраняется гипотензия, то в качестве средства лечения назначают допамин в дозе 7-10 мкг/кг/мин.
Учитывая высокую вероятность развития пневмонии, детям для лечения сразу назначают антибиотики широкого спектра действия. В дальнейшем антибактериальная терапия меняется в соответствии с данными бактериального обследования и антибиотикограммы.
Последствия аспирации меконием . При несвоевременном удалении мекония из дыхательных путей и осложнении мекониальной аспирацией осложненной синдромом персистирующей легочной гипертензии летальность достигает 10%. При благоприятном течении даже при массивной аспирации рентгенограмма нормализуется к 2 неделям, но повышенная пневматизация легких и участки фиброза могут наблюдаться несколько месяцев.
Теперь вы знаете о том, что такое синдром аспирации мекония у новорожденных.
