
Цель исследования. Оценить эффективность определения уровня эозинофилов индуцированной мокроты как дополнительного диагностического критерия бронхиальной астмы.
Материалы и методы. Когортное исследование уровня эозинофилов индуцированной мокроты проводилось в течение 10 лет, под наблюдением находилась группа 75 детей в возрасте от 1 года до 5 лет (средний возраст 2,8±1,2 года.) с ООБ в анамнезе, сформированная методом случайной выборки из детей, перенесших один и более эпизодов острого обструктивного бронхита, обратившихся на прием к врачу-аллергологу с целью обследования для исключения бронхиальной астмы. На всех детей была заполнена персональная анкета, содержащая данные анамнеза, объективного осмотра и результаты проведенных исследований. Всем респондентам в декретированные сроки был проведен цитологический анализ назального секрета, индуцированной мокроты, исследование уровня общего IgE крови, уровня эозинофилов крови. Для получения мокроты с целью ее цитологического анализа проводили процедуру индукции мокроты [9; 11; 12]. В данном исследовании за диагностически значимый уровень эозинофилов индуцированной мокроты принят показатель ≥ 5%. Из исследования исключались пациенты с подтвержденной паразитарной инфекцией.
Исследование проводили поэтапно. Повторное обследование детей проведено через 18 месяцев и через 10 лет от начала исследования. По окончании наблюдения пациенты были разделены на две группы. Первая группа (n=46) – дети, у которых бронхиальная астма не сформировалась за время исследования. Вторая группа (n=29) – дети со сформировавшейся бронхиальной астмой.
Статистический анализ полученных результатов проводился при помощи пакетов статистических программ STATISTICA 6.0 (StatSoft, 2001) и SPSS 12.0. Для описания количественных признаков в выборке рассчитывались медиана и квартили (Ме; 25-75%). Для сравнительного анализа данных в двух зависимых группах при распределении количественных признаков, отличных от нормального, использовался критерий Вилкоксона. С целью оценки клинической информативности диагностических тестов проводился ROC-анализ и анализ четырехпольной таблицы для оценки чувствительности и специфичности диагностического критерия. Для всех видов анализа статистически достоверными считались значения p 0,05). У детей второй группы уровень эозинофилов ИМ был изначально высоким — 6,0 (2,4-17,0), и отмечался его статистически значимый рост в динамике через 18 месяцев наблюдения – 12,0 (4,0 — 22,0) (рwilc. 1,0-0,9 – отличное, 0,9-0,8 – очень хорошее, 0,8-0,7 – хорошее, 0,7-0,6 – среднее, 0,6-0,5 – метод неинформативен. Таким образом, чем больше эта площадь, тем эффективнее метод диагностики. В данном исследовании AUC-ROC (рис. 1) площадь под кривой равна 0,944, что говорит о высокой диагностической эффективности этого метода – 94,4%. В аналогичных исследованиях с участием детей старше 5 лет и взрослых было продемонстрировано, что процент эозинофилов в мокроте является наиболее чувствительным и специфичным маркером в сравнении с эозинофилией крови и уровнем общего IgE крови при БА 12.
Для того чтобы была возможность сравнить чувствительность и специфичность использующихся в настоящее время показателей для диагностики БА, было проведено построение ROC-кривой по другим диагностическим тестам. Построены ROC-кривые диагностики по уровню эозинофилов ОАК (%) и общему IgE крови (МЕ/мл). Эти показатели были использованы, так как они являются лабораторными критериями, отражающими наличие аллергии и/или атопии, и используются врачами педиатрами и аллергологами при постановке диагноза БА (рис. 2, 3).
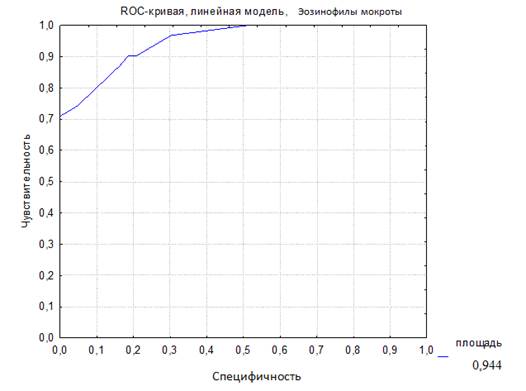
Рис. 1. ROC-кривая диагностической эффективности уровня эозинофилов индуцированной мокроты (AUC-ROC 0,944)

Рис. 2. ROC-кривая диагностической эффективности уровня эозинофилов в общем анализе крови (AUC-ROC 0,61)
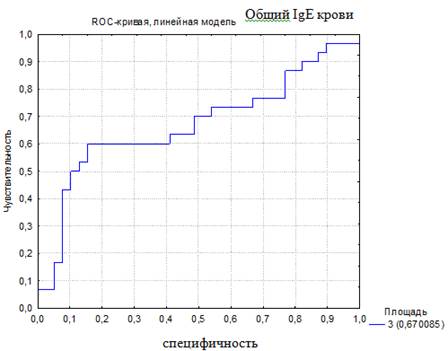
Рис. 3. ROC-кривая диагностической эффективности уровня общего IgE крови
Втечение последних двух десятилетий достигнуты значительные успехи в ведении пациентов с бронхиальной астмой (БА) благодаря использованию улучшенных стратегий диагностики, терапии и профилактики болезни
Клиническая диагностика
Современное определение астмы сфокусировано на хроническом воспалительном процессе в дыхательных путях, в котором принимают участие многие клетки и клеточные элементы. Для астмы типичны четыре главных компонента:
- симптомы;
- обратимость бронхиальной обструкции;
- бронхиальная гиперреактивность;
- воспаление.
Какой-то один домен не может быть основой для диагноза, но не все исследователи имеют возможность объективно оценивать все четыре компонента, особенно в педиатрии. Поэтому у детей первых пяти лет жизни рекомендуется для постановки диагноза БА использовать тщательный сбор семейного и индивидуального анамнеза, анализ симптомов, физикальное обследование.
Анамнез
Для детей пяти лет и младше, имеющих повторяющиеся респираторные симптомы, предположить диагноз БА позволяет семейный анамнез — указания на наличие астмы у ближайших родственников (особенно матери), и/или атопии (атопический дерматит, экзема), пищевой аллергии, аллергического ринита у кровных родственников или самого ребенка.
Симптомы
К основным симптомам астмы относятся свистящие хрипы, эпизоды одышки, кашель, заложенность в грудной клетке.
Свистящие хрипы
Свистящие хрипы (wheeze) — непрерывные музыкальные звуки, продолжающиеся не менее 250 мс и вызываемые вибрацией противоположных стенок дыхательных путей, что приводит к их сужению вплоть до полного закрытия. Хрипы могут быть высоко- и низкотональными, состоящими из одного или нескольких звуковых оттенков, возникающих как во время вдоха, так и выдоха, создаваемых дыхательными путями любого размера — от крупных экстраторакальных до мелких интраторакальных. К появлению свистящих хрипов может приводить обструкция: верхних и нижних экстраторакальных дыхательных путей, нижних дыхательных путей. Астма не является самой частой причиной свистящих хрипов. У детей, особенно в возрасте младше трех лет, отмечается чрезвычайно широкая распространенность хрипов в грудной клетке и кашля даже в отсутствие БА [18, 29]. Выделяют три типа свистящих хрипов в младшей возрастной группе:
Преходящие ранние хрипы:
Персистирующие хрипы с ранним началом (в возрасте до трех лет) у детей без признаков атопии или семейного анамнеза атопии:
- эпизоды хрипов в грудной клетке, обусловленные респираторными вирусными инфекциями: у детей до двух лет с респираторно-синцитиальной вирусной инфекцией; у детей дошкольного возраста старше двух лет — с прочими вирусными инфекциями;
- эти эпизоды, как правило, продолжаются и в школьном возрасте, к 12 годам их можно выявить у значительной части детей.
Хрипы с поздним началом/БА:
- отмечаются в течение всего детства и во взрослом возрасте;
- типична атопия в анамнезе (часто проявляющаяся как атопический дерматит/экзема) и характерные для БА нарушения бронхиальной проходимости;
- для астмы характерны периодически возникающие хрипы, а также хрипы, возникающие во время сна, смеха, при плаче.
Кашель
Кашель как симптом БА у детей младшей возрастной группы имеет следующие особенности:
- возникает периодически или присутствует постоянно (вне связи с простудой или респираторной инфекцией);
- нередко сопровождается хрипами и затрудненным дыханием, одышкой;
- типично появление кашля в ночное время или перед пробуждением;
- физическая нагрузка, смех, плач усиливают кашель.
Дополнительные методы обследования для подтверждения диагноза астмы
Исследование функции легких нередко является недостаточно надежным методом у детей младшего возраста. Дети в возрасте 4–5 лет могут научиться пользоваться пикфлоуметром, однако для получения точных результатов пикфлоуметрия должна проводиться под наблюдением родителей.
В научных целях в крупных исследовательских центрах используются такие методы, как бодиплетизмография для измерения сопротивления дыхательных путей, определения легочных объемов, методы разведения газов (обычно с использованием гелия) и вымывания инертных индикаторных газов (обычно азот); импульсная осциллометрия, повышение объема форсированного выдоха при торакоабдоминальной компрессии (RVRTC — Raised-Volume Rapid Thoracoabdominal Compression) и др. [5, 30]. Эти исследования требуют сложного оборудования, что затрудняет их применение в рутинной клинической практике. В России был предложен метод бронхофонографии, который позволяет с помощью компьютера анализировать паттерны дыхания и дает дополнительную информацию о характере нарушения дыхательной функции [1].
Эпизодические респираторные симптомы, такие как свистящее дыхание и кашель, часто могут встречаться и у детей без астмы, особенно в первые два года жизни. Поскольку в данной возрастной группе отсутствует возможность оценивать бронхиальную обструкцию и ее обратимость с помощью объективных методов, то дополнительное использование тестов для выявления атопии и обнаружение аллергенспецифических IgE может быть дополнительным аргументом для подтверждения диагноза астмы. Аллергическая сенсибилизация — главный фактор риска для развития астмы, персистенции и тяжести. Наличие атопического дерматита у ребенка и/или пищевой аллергии увеличивает риск сенсибилизации к ингаляционным аллергенам и может быть предиктором развития астмы.
Неинвазивные маркеры воспаления в дыхательных путях (определение оксида азота в выдыхаемом воздухе — NОx или окиси углерода СОx неспецифичны для БА, также требуют специального оборудования и пока не рекомендуются для рутинной практики у детей раннего возраста [25].
Рентгенографическое исследование грудной клетки не играет большой роли в диагнозе БА. Данный метод помогает исключить другие заболевания. У детей чаще всего это структурные аномалии дыхательных путей (например, врожденные пороки развития, врожденная эмфизема долевая, сосудистое кольцо) или другие диагнозы [28].
Таким образом, подходы к диагностике БА у детей в возрасте пяти лет и младше отличаются от других возрастных групп. Диагноз БА обычно основывается только на жалобах, данных анамнеза и осмотра и типичных симптомах.
Признаками вероятной БА у детей в возрасте пяти лет и младше являются:
- частые эпизоды свистящих хрипов в грудной клетке (более одного в месяц);
- кашель или хрипы, вызванные физической нагрузкой;
- кашель по ночам в отсутствие вирусной инфекции;
- отсутствие сезонных изменений хрипов, а также сохранение симптомов после трех лет.
Дифференциальная диагностика
Для окончательного принятия решения о диагнозе БА необходимо исключить заболевания, которые также могут сопровождаться повторными эпизодами свистящих хрипов у детей:
- инфекционные процессы (повторные вирусные инфекции нижних дыхательных путей, хронический риносинусит, туберкулез);
- врожденные аномалии (бронхолегочная дисплазия, синдром первичной цилиарной дискинезии, муковисцидоз, иммунодефицит; пороки развития, обусловливающие сужение внутригрудных дыхательных путей; врожденные пороки сердца, трахеомаляция);
- механические проблемы (аспирация инородного тела, гастроэзофагеальный рефлюкс).
Лечение астмы у детей пяти лет и младше
После верификации диагноза астмы выбираются оптимальные стратегии терапевтических вмешательств с точки зрения доказательной медицины.
Важным компонентом лечения является создание партнерских отношений между врачом и родителями (опекунами), членами семьи больного ребенка. Повышают эффективность терапии образовательные программы.
У детей младшей возрастной группы имеются свои особенности в оценке уровней контроля (табл. 2). Они основаны на клинических признаках, отсутствует определение функции внешнего дыхания (ФВД), отличается подход к определению неконтролируемой астмы [2, 6, 27, 28].
Несмотря на то, что терапия ИГКС является краеугольным камнем терапии у детей младшей возрастной группы, предметом дискуссии остается вопрос о том, как рано следует начинать базисную терапию, стоит ли уже после 1–2 эпизодов бронхиальной обструкции включать на регулярной основе ИГКС у детей раннего возраста. Существуют определенные опасения по поводу раннего (после 1–2 эпизодов обструкции) назначения ИГКС у маленьких детей. Сдержанное отношение обусловлено тем, что ИГКС могут оказывать влияние на рост альвеол, есть определенные трудности в прогнозировании хорошей эффективности, продолжительное лечение ИГКС у маленьких детей не всегда влияет на естественное течение заболевания и, кроме того, клеточное воспаление и ремоделирование могут зависеть от других патогенетических механизмов. Поскольку пока нет доказательств, что использование ИГКС в подобных случаях приносит пользу, большинство экспертов считает, что использование ИГКС должно быть ограничено только контингентом детей с атопической экземой, или аллергической сенсибилизацией, или отягощенным по атопии семейным анамнезом с тремя и более эпизодами бронхоспазма, развившегося на фоне вирусной инфекции [7, 9, 24, 28]. Эквипотентные дозы ИГКС для детей этой группы представлены в табл. 3.
.jpg)
Как и в других возрастных группах, у детей пяти лет и младше предпочтение отдается ингаляционной терапии. Выбор ингаляционного устройства проводится на индивидуальной основе [2, 6, 13, 17, 23, 28]. Возможные способы доставки представлены в табл. 4.
.jpg)
При использовании низких доз ИГКС клинически значимых серьезных побочных системных эффектов в клинических испытаниях не установлено и препараты считаются безопасными (уровень доказательности А). Более высокие дозы могут сопровождаться некоторыми системными эффектами [2, 3, 23].
Антилейкотриеновые препараты
Важным вариантом лечения для детей с БА в возрасте ≤ 5 лет кроме ИГКС являются антилейкотриеновые препараты (АЛП). Эта точка зрения базируется на большом количестве данных, доказывающих эффективность антилейкотриенового препарата монтелукаста в отношении улучшения контроля астмы [2, 7, 23, 28, 31]. Было показано, что монтелукаст эффективен в лечении детской астмы, вызванной распространенными триггерами (вирусы, физическая нагрузка, аллергены). Монтелукаст в настоящее время рекомендуется в качестве одного из двух вариантов начала лечения детей с персистирующей БА.
Кроме того, АЛП снижают частоту обострений БА, обусловленных вирусной инфекцией, у детей в возрасте 2–5 лет с интермиттирующей БА в анамнезе.
Роль монтелукаста как альтернативы препаратам первого выбора (ИГКС) для базисной терапии БА еще раз указывает на важность раннего начала лечения воспаления и расширяет возможности врача в отношении индивидуального подбора терапии.
Из всех антилейкотриеновых препаратов при детской астме изучался только монтелукаст (сильнодействующий селективный анатагонист цис-ЛТ-1-рецепторов), который продемонстрировал высокий профиль безопасности у детей раннего возраста.
Кромоны
Кромогликат натрия и недокромил натрия играют небольшую роль в длительной терапии БА у детей [2, 28, 35].
Кромоны обладают очень слабым противовоспалительным эффектом и являются менее эффективными, чем даже низкие дозы ИГКС.
Результаты одного метаанализа показали, что длительная терапия кромогликатом натрия у детей с БА статистически значимо не превосходила по эффективности плацебо. Данные другого метаанализа подтвердили превосходство низких доз ИГКС перед кромогликатом натрия при персистирующей БА.
Показано, что недокромил натрия уменьшает частоту обострений, однако его влияние на другие параметры состояния при БА не отличалось от влияния плацебо.
Однократный прием кромогликата натрия или недокромила натрия уменьшал выраженность бронхоспазма, обусловленного физической нагрузкой или вдыханием холодного воздуха.
Кромоны имеют высокий профиль безопасности. Побочные эффекты — кашель, раздражение глотки и бронхоспазм у небольшой части пациентов, получающих кромогликат натрия. Самыми частыми побочными эффектами недокромила являются неприятный вкус, головная боль и тошнота [28].
В Кохрановском обзоре был сделан вывод, что положительный эффект лечения кромолином натрия у дошкольников не доказан (уровень доказательности А) [35], а недокромил не был изучен у детей дошкольного возраста. Таким образом, кромоны не рекомендуются для лечения БА в этой возрастной группе.
Теофиллин
У детей в возрасте пяти лет и младше нет достаточного количества доказательных исследований, но те немногие данные, которые были получены, подтверждают наличие определенного клинического эффекта теофиллина. В нескольких исследованиях у детей пяти лет и младше клинический эффект от регулярного применения теофиллина был невелик и в основном статистически незначим [32]. Эффективность теофиллина меньше, чем низких доз ИГКС, а побочные эффекты распространены (уровень доказательности D).
Длительно действующие бета2-агонисты (ДДБА)
Последний Экспертный совет FDA единогласно проголосовал за то, что у детей риск монотерапии ДДБА перевешивает пользу.
ДДБА не представлены в качестве варианта лечения ни для одной из ступеней терапии в данной возрастной группе [16, 20, 24, 28, 34]. Назначение ДДБА как альтернативы повышению доз ИГКС не рассматривается, предпочтение отдается повышению дозы ГКС.
У детей в возрасте пяти лет и младше эффекты ингаляционных бета2-агонистов длительного действия или комбинированных препаратов (ДДБА/ИГКС) изучены недостаточно [2, 28]. Комбинированные препараты (ДДБА/ИГКС) лицензированы для использования у детей 4–5 лет, однако у детей младше четырех лет доказательных исследований не проводилось.
Подходы к ступенчатой фармакотерапии БА у детей пяти лет и младше с позиций достижения и сохранения контроля представлены в табл. 5. [6, 28].
Бета2-агонисты короткого действия
Как видно из табл. 5, для всех пациентов в качестве бронхорасширяющей терапии могут использоваться ингаляционные бета2-агонисты короткого действия, которые являются наиболее эффективными ситуационными препаратами [2, 6, 28]. Предпочтительным способом доставки для купирования приступа астмы у детей пяти лет и младше является дозируемое аэрозольное устройство со спейсером (уровень доказательности А). Если техника ингаляции не выполнима (из-за отсутствия комплаенса, дистресса или из-за выраженности бронхоспазма и гипоксии), может использоваться небулайзерная терапия. Назначение бронхолитиков per os не рекомендуется из-за медленного начала действия и увеличения частоты системных эффектов. Ингаляционные бета2-агонисты короткого действия являются препаратами выбора, и по сравнению с ними назначение ингаляций ипратропия бромида не играет важной роли в повседневной практике ведения детей пяти лет и младше с БА (уровень доказательности А) [21].
Некоторые дети могут быть нечувствительны к эффектам ИГКС. В таких случаях необходимо вместе с родителями обсудить проблемы комплаенса, проверить технику ингаляции. При соблюдении всех условий правильного лечения следует подумать о фенотипе астмы, трудно поддающейся лечению [4, 10, 22, 24, 26, 33] и пересмотреть назначенную терапию. Важным компонентом контролируемого течения БА является предотвращение острых приступов астмы [11].
При приступах БА не рекомендуется следующая терапия:
- седативные препараты (строго противопоказаны);
- муколитические препараты (могут усилить кашель);
- все виды физиотерапии, включая физиотерапию на грудную клетку (могут усилить дискомфорт пациента);
- гидратация для детей старшего возраста и взрослых большими объемами жидкости (может быть необходима для детей младшего возраста и грудных детей);
- антибиотики (не лечат обострение, однако могут быть показаны для тех, кто имеет сопутствующую пневмонию или другую бактериальную инфекцию, например синусит);
- легкие обострения можно лечить на дому, если ребенок/семья подготовлены для этого и имеется индивидуальный план самоведения, включающий пошаговые мероприятия);
- среднетяжелые обострения, скорее всего, потребуют, а тяжелые — обычно требуют лечения в медицинском учреждении.
Для лечения обострений используются специальные протоколы.
Внедрение в клиническую практику доказательных методов диагностики и терапии астмы у детей пяти лет и младше будет способствовать эффективному и безопасному ведению самых маленьких пациентов.
Литература
СГМУ им. В. И. Разумовского, Саратов
Контактная информация об авторах для переписки: astang@mail.ru
Уровни контроля астмы у детей 5 лет и младше [27, 28]
Подход к лечению астмы, ориентированный на контроль астмы для детей в возрасте 5 лет и младше

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
При типичных жалобах пациента используют определённый алгоритм диагностики бронхиальной астмы.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Анамнез и физикальное обследование
Вероятность бронхиальной астмы возрастает, если в анамнезе присутствуют:
- атопический дерматит;
- аллергический риноконъюнктивит;
- отягощенный семейный анамнез по бронхиальной астме или другим атопическим заболеваниям.
Диагноз бронхиальной астмы часто можно предположить, если у пациента присутствуют следующие симптомы:
- эпизоды одышки;
- свистящие хрипы;
- кашель, усиливающийся преимущественно в ночные или предутренние часы;
- заложенность в грудной клетке.
Появление или усиление симптомов бронхиальной астмы:
- после эпизодов контакта с аллергенами (при контакте с животными, клещами домашней пыли, пыльцевыми аллергенами);
- в ночные и предутренние часы;
- при контакте с триггерами (химические аэрозоли, табачный дым, резкий запах);
- при перепадах температуры окружающей среды;
- при любых острых инфекционных заболеваниях дыхательных путей;
- при сильных эмоциональных нагрузках;
- при физической нагрузке (пациенты отмечают типичные симптомы бронхиальной астмы или иногда длительный кашель, обычно возникающий через 5-10 мин после прекращения нагрузки, редко — во время нагрузки, который самостоятельно проходит в течение 30-45 мин).
При осмотре необходимо обратить внимание на следующие признаки, характерные для бронхиальной астмы:
- одышка;
- эмфизематозная форма грудной клетки;
- вынужденная поза;
- дистанционные хрипы.
При перкуссии возможен коробочный перкуторный звук.
Во время аускультации определяют удлинение выдоха или свистящие хрипы, которые могут отсутствовать при обычном дыхании и обнаруживаться только во время форсированного выдоха.
Необходимо учитывать, что в связи с вариабельностью астмы проявления болезни могут отсутствовать, что не исключает бронхиальную астму. У детей в возрасте до 5 лет диагноз бронхиальной астмы основан главным образом, на данных анамнеза и результатах клинического (но не функционального) обследования (большинство педиатрических клиник не располагают такой точной аппаратурой). У детей грудного возраста, имевших три эпизода свистящих хрипов и более, связанных с действием триггеров, при наличии атопического дерматита и/или аллергический ринит, эозинофилии в крови следует подозревать бронхиальную астму, проводить обследование и дифференциальную диагностику.

[12], [13], [14], [15], [16]
Лабораторная и инструментальная диагностика бронхиальной астмы
У детей старше 5 лет необходимо проводить оценку функции внешнего дыхания. Спирометрия позволяет оценить степень обструкции, её обратимость и вариабельность, а также тяжесть течения заболевания. Однако спирометрия позволяет оценивать состояние ребёнка только на момент осмотра. При оценке показателей ОФВ1 и форсированной жизненной ёмкости лёгких (ФЖЁЛ) важно ориентироваться на должные показатели, полученные в ходе популяционных исследований, которые учитывают этнические особенности, пол, возраст, рост.
Таким образом, оценивают следующие показатели:
- ОФВ ;
- ФЖЕЛ;
- отношение ОФВ,/ФЖЁЛ;
- обратимость бронхиальной обструкции — увеличение ОФВ, по крайней мере на 12% (или 200 мл) после ингаляции сальбутамола либо в ответ на пробное лечение глюкокортикостероидами.
Пикфлоуметрия (определение ПСВ) — важный метод диагностики и последующего контроля лечения бронхиальной астмы. Последние модели пикфлоуметров относительно недороги, портативны, выполнены из пластика и идеально подходят для использования пациентами старше 5 лет в домашних условиях с целью ежедневной оценки течения бронхиальной астмы. При анализе показателей ПСВ у детей используют специальные номограммы, но более информативен ежедневный мониторинг ПСВ в течение 2-3 нед для определения индивидуального наилучшего показателя. ПСВ измеряют утром (обычно наиболее низкий показатель) до ингаляций бронхолитиков, если ребёнок их получает, и вечером перед сном (как правило, наиболее высокий показатель). Заполнение больным дневников самоконтроля с ежедневной регистрацией в нём симптомов, результатов ПСВ играет важную роль в стратегии лечения бронхиальной астмы. Мониторинг ПСВ может быть информативен для определения ранних симптомов обострения заболевания. Дневной разброс показателей ПСВ более 20% рассматривают как диагностический признак бронхиальной астмы, а величина отклонений прямо пропорциональна тяжести заболевания. Результаты пикфлоуметрии свидетельствуют в пользу диагноза бронхиальной астмы, если ПСВ увеличивается по крайней мере на 15% после ингаляции бронхолитика или при пробном назначении глюкокортикосетроидов.
Таким образом, важно оценить:
- суточную вариабельность ПСВ (разность между максимальным и минимальным значениями в течение дня, выраженную в процентах от средней за день ПСВ и усреднённую за 1-2 нед);
- минимальное значение ПСВ за 1 нед (измеряемой утром до приёма бронхолитика) в процентах от самого лучшего в этот же период показателя (Min/Max).
У пациентов с симптомами, характерными для бронхиальной астмы, но с нормальными показателями функции лёгких, в постановке диагноза БА может помочь исследование реакции дыхательных путей на физическую нагрузку.
У некоторых детей симптомы бронхиальной астмы провоцирует только физическая нагрузка. В этой группе полезно проведение нагрузочного теста (6-минутный протокол нагрузки бегом). Использование этого метода исследования совместно с определением ОФВ, или ПСВ может быть полезно для постановки точного диагноза бронхиальной астмы.
Для выявления бронхиальной гиперреактивности можно применять тест с метахолином или гистамином. В педиатрии их назначают крайне редко (в основном у подростков), с большой осторожностью, по особым показаниям. При диагностике бронхиальной астмы эти тесты имеют высокую чувствительность, но низкую специфичность.
Специфическую аллергологическую диагностику проводят врачи-аллергологи/иммунологи в специализированных учреждениях (отделениях/кабинетах).
Аллергологическое обследование обязательно для всех больных с бронхиальной астмой, оно включает: сбор аллергологического анамнеза, проведение кожного тестирования. определение уровня общего IgE (и специфических IgE в случаях, когда невозможно проведение кожных проб).
Кожные тесты с аллергенами и определение уровней специфических IgE в сыворотке крови помогают выявить аллергический характер заболевания, установить причинно-значимые аллергены, на основании чего рекомендуют соответствующий контроль факторов окружающей среды (элиминационный режим) и разрабатывают схемы специфической иммунотерапии.
Неинвазивное определение маркёров воспаления дыхательных путей (дополнительные диагностические методы):
- исследование мокроты, спонтанно продуцируемой или индуцированной ингаляцией гипертонического раствора натрия хлорида, на клетки воспаления (эозинофилы или нейтрофилы);
- определение уровня оксида азота (NО) и окиси углерода (FeCO) в выдыхаемом воздухе.

[17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28]
Определение тяжести обострений бронхиальной астмы
